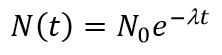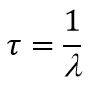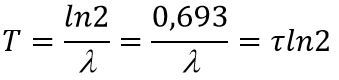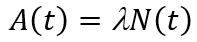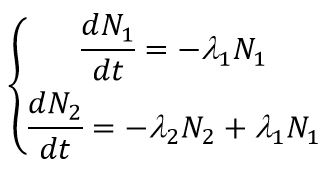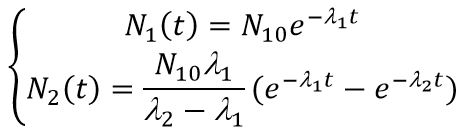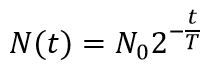При изучении процесса радиоактивного распада было установлено, что не все ядра радиоактивного изотопа распадаются одновременно, в каждую единицу времени распадается лишь некоторая доля общего числа радиоактивного элемента. Каждое радиоактивное ядро может распасться в любой момент и закономерность наблюдается только в среднем, в случае распада достаточно большого количества ядер.
Постоянная распада λ - вероятность распада ядра в единицу времени.
Если в образце в момент времени t имеется N радиоактивных ядер, то количество ядер dN, распавшихся за время dt пропорционально N.
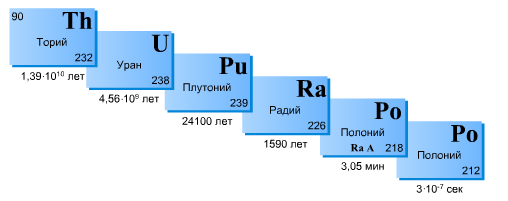
Закон радиоактивного распада: количество атомов данного изотопа, претерпевающего ядерное превращение в 1 с, пропорционально общему их количеству, или иначе: в равные промежутки времени имеет место ядерное превращение равных долей активных атомов изотопа.
N – число ядер, не распавшихся за время t,
N0 - количество радиоактивных ядер в момент времени t = 0,
λ – постоянная распада, различна для разных радиоактивных веществ.
Cреднее время жизни τ – промежуток времени τ, в течение которого система распадается с вероятностью 1 – 1/e:
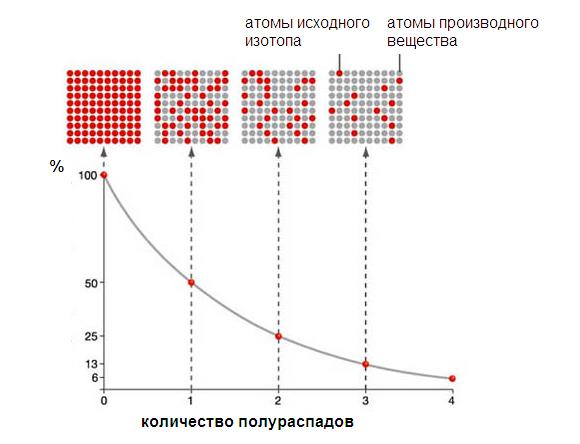
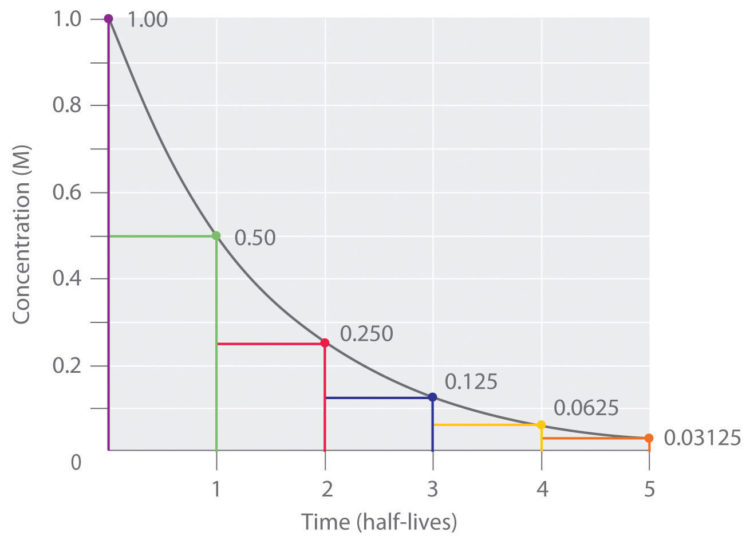
Период полураспада – это время, в течение которого распадается половина радиоактивных ядер:
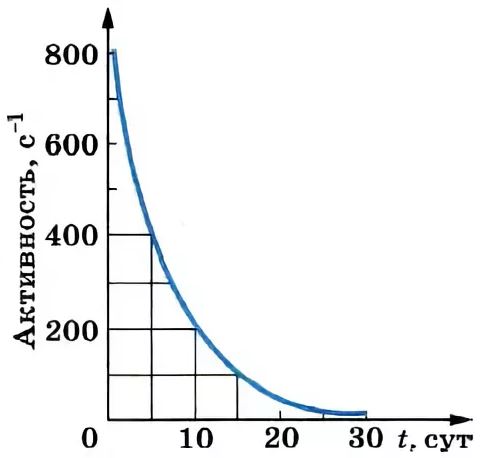
Активность радиоактивного препарата – число ядер этого препарата, распадающихся за секунду.
Активность измеряется в кюри (Ки) и беккерелях (Бк)
1 Ки = 3,7·1010 распадов/c, 1 Бк = 1 распад/c, внесистемная единица активности – резерфорд (Рд). 1 Рд =106 Бк.
Распад исходного ядра 1 в ядро 2, с последующим его распадом в ядро 3, описывается системой дифференциальных уравнений:
Решением системы с начальными условиями N1(0) = N10; N2(0) = 0 будет
Для практического использования закон радиоактивного распада можно записать так :
Изотопы – разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Изотопами называются разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
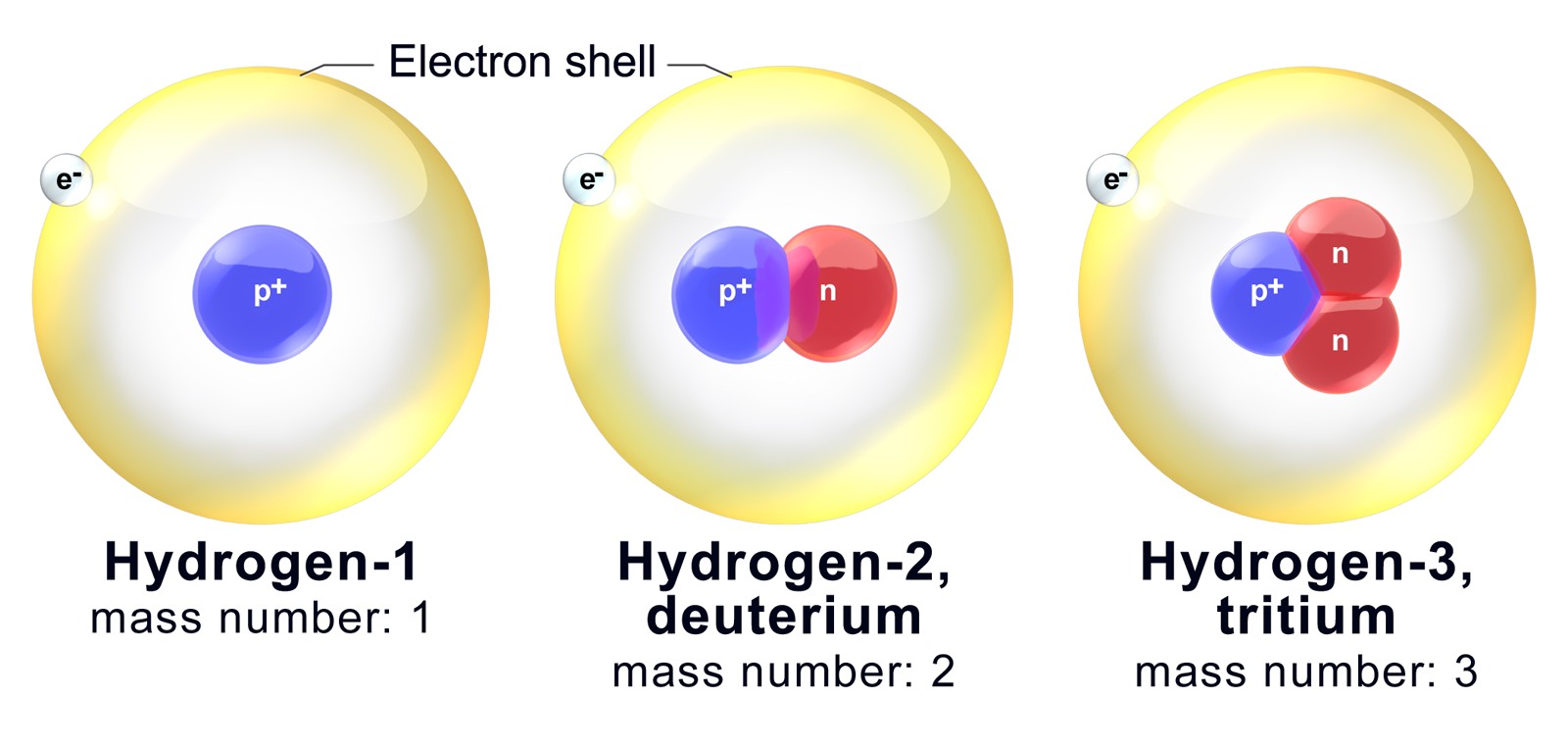
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2H и 3H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1H называют иногда протием).
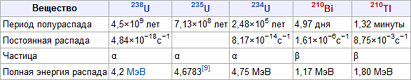
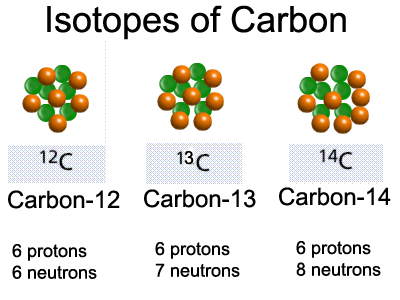
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада). Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов). Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
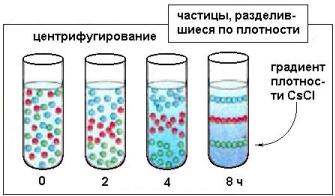
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.