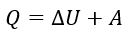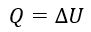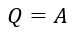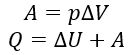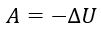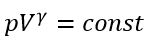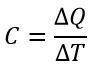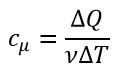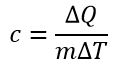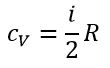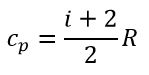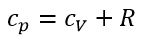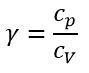I закон термодинамики – это закон сохранения энергии, распространенный на тепловые явления.
Энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую
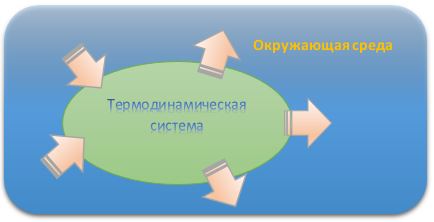
Термодинамическаясистема— совокупность макроскопических тел,которые могут взаимодействовать между собой и с другими телами (внешнейсредой) — обмениваться с ними энергией и веществом, отделенная от внешней среды реальной или воображаемой оболочкой.
Первый закон термодинамики
|
Количество теплоты Q, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами |
Следствие: любая машина (любой двигатель) может совершать работу только за счет получения извне некоторого количества теплоты или уменьшения своей внутренней энергии.
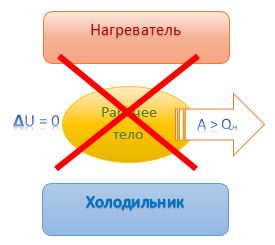
Вечный двигатель первого рода (совершающий бОльшую работу, чем полученное количество теплоты) не возможен – таков вывод из первого закона термодинамики.
|
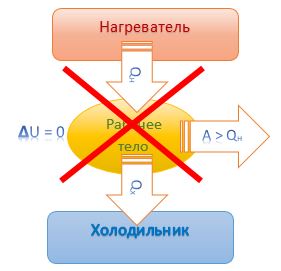
Невозможен вечный двигатель, совершающий работу, не получая энергии извне |
Невозможен вечный двигатель, совершающий бОльшую работу, чем полученное количество теплоты |
I закон термодинамики в применении к изопроцессам
|
Изохорный V = const |
Газ работы не совершает При изохорном нагревании тепло поглощается телом При изохорном охлаждении тепло отдается внешним телам (Q<0). |
|
Изотермический T = const |
Внутренняя энергия не изменяется Количество теплоты, полученное газом при изотермическом расширении, превращается в работу над внешними телами. При изотермическом сжатии, работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам. |
|
Изобарный p = const |
При изобарном расширении тепло поглощается газом При изобарном сжатии (Q<0) тепло отдается внешним телам. В этом случае работа совершается над газом (A<0). Температура и внутренняя энергия уменьшаются. |
|
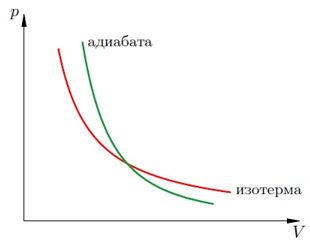
Адиабатный Q = 0 |
Процесс, протекающий в отсутствие теплообмена с окружающими телами Газ совершает работу за счет убыли внутренней энергии: при адиабатическом расширении газ совершает положительную работу, при этом его внутренняя энергия уменьшается. Это приводит к уменьшению его температуры. Вследствие этого давление убывает быстрее, чем при изотермическом расширении. |
Адиабатный процесс — это процесс, при котором не происходит теплообмена с внешней средой. Физически это означает, что процесс протекает достаточно быстро и система не успевает обменяться теплотой с внешними телами.
Уравнение адиабатного процесса
Теплоёмкость тела — физическая величина, определяющая отношение бесконечно малого количества теплоты ΔQ, полученного телом, к соответствующему приращению его температуры ΔT:
Молярная теплоёмкость — это теплоёмкость одного моля вещества.
Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг·К)).
Теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const)
и Cp – молярная теплоемкость в изобарном процессе (p = const).
Ср всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. Уравнение Майера:
Газовая постоянная R — это работа, совершаемая молем идеального газа при повышении его температуры на 1 К при постоянном давлении.
Показатель адиабаты (коэффициент Пуассона)