Одно и то же вещество в зависимости от внешних условий может находиться в различных агрегатных состояниях: твёрдом, жидком или газообразном. В разных состояниях различаются свойства вещества.
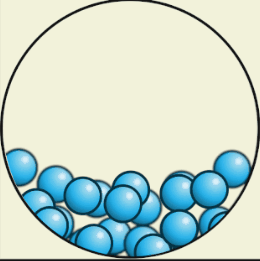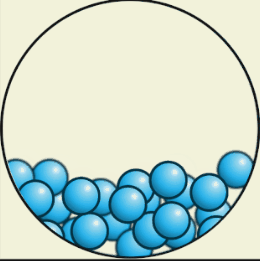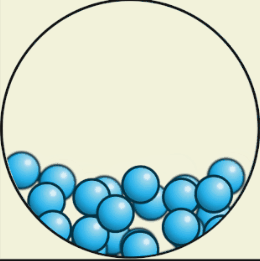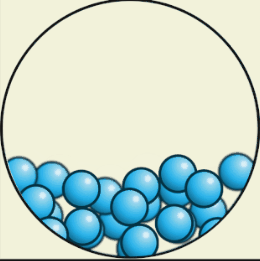
В жидком состоянии
Вещества текучи, приобретают форму сосуда, т. е. сохраняют объём, но не форму. Также жидкости трудно сжать (несжимаемы).
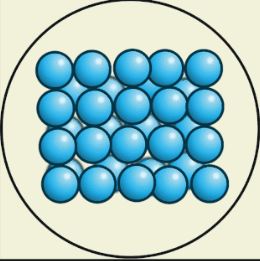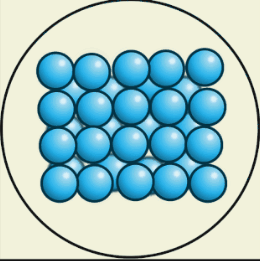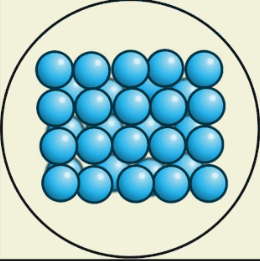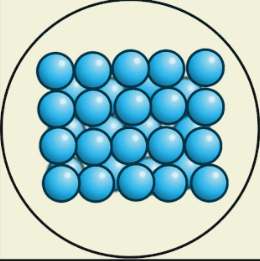
В твёрдом состоянии
В твёрдом состоянии вещества сохраняют и объём, и форму. Их трудно сжать. Чтобы перевести в жидкое состояние, вещество можно нагреть до определённой температуры.
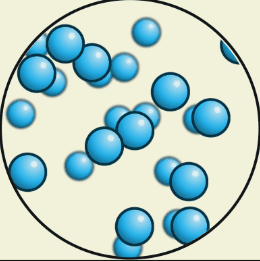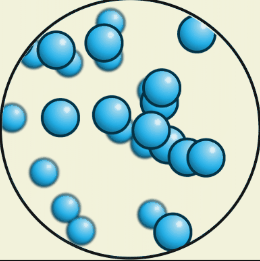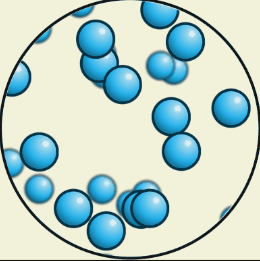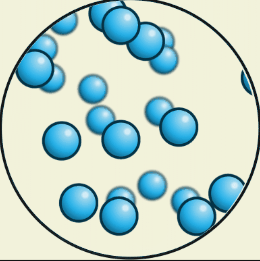
В газообразном состоянии
Газы не сохраняют ни форму, ни объём, они занимают весь предоставленный им сосуд. Газы значительно легче сжать, чем жидкости и твёрдые тела.
Во всех агрегатных состояниях вещество состоит из частиц — атомов или молекул. В чём же разница? Как одни и те же частицы могут создавать состояния с такими разными свойствами? Причина в различии строения вещества и взаимодействия его частиц в разных агрегатных состояниях.
Взаимодействие частиц вещества
Представьте, что хаотично движущиеся частицы вещества перестали бы взаимодействовать друг с другом. Тогда они разлетелись бы по всему предоставленному объёму, и единственно возможное состояние такого вещества было бы газообразное.
Если нет взаимодействия
Если же взаимодействие есть, то оно:
1) действует только на малых расстояниях;
2) бывает двух типов: притяжение и отталкивание.
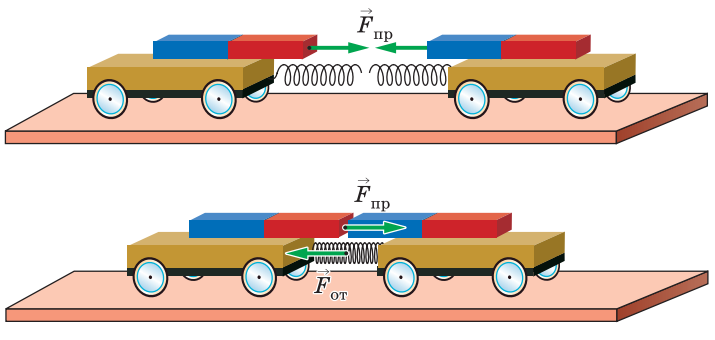
Продемонстрируем модель взаимодействия молекул на примере двух тележек с магнитами, соединённых пружиной. Магниты будут служить причиной притяжения тележек, пружина при сжатии будет стремиться оттолкнуть тележки друг от друга. В некотором состоянии равновесия силы притяжения и отталкивания уравновесят друг друга, и тележки будут находиться в покое. При уменьшении расстояния будут преобладать силы отталкивания, при увеличении — притяжения.
Если бы отсутствовало хаотичное движение молекул, то они все находились бы в этом равновесном состоянии. Но частицы движутся и взаимодействуют одновременно, поэтому то, в каком агрегатном состоянии будет находиться вещество, зависит от соотношения скорости движения и силы взаимодействия молекул.
В газах молекулы расположены далеко друг от друга, поэтому большую часть времени они движутся прямолинейно и равномерно до столкновения с другой молекулой или со стенкой сосуда.
В жидкостях молекулы расположены близко друг к другу. Взаимодействие в жидкостях достаточно велико, чтобы они сохраняли объём, не недостаточно велико для сохранения формы.
В твёрдых телах молекулы расположены на расстояниях, близких к размерам молекул. При попытке увеличить расстояние (растянуть тело) начинают преобладать силы притяжения; при попытке сжать — преобладают силы отталкивания. Этим объясняется то, что твёрдые тела сохраняют форму и объём.
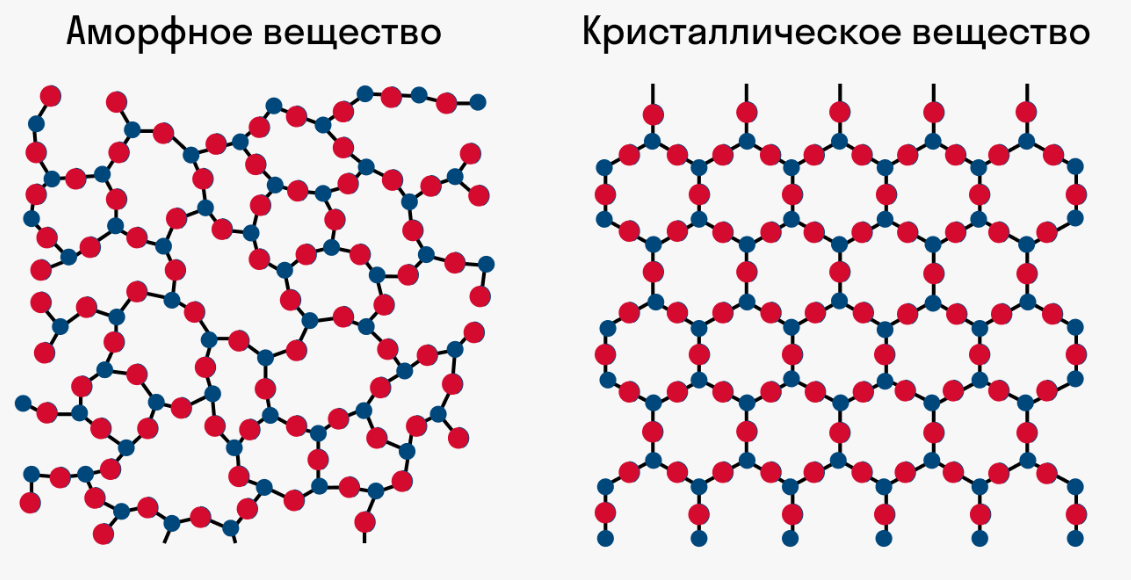
Твёрдые тела бывают двух видов: кристаллические и аморфные. Причём некоторые вещества имеют только одну форму, а другие могут существовать в обеих при разных условиях.
Кристаллическое состояние
У кристаллов есть упорядоченная объёмная структура — кристаллическая решётка. Их особенности:
1) различие свойств кристалла по разным направлениям (анизотропия);
2) определённая температура плавления.
Аморфное состояние вещества
В аморфном состоянии у вещества нет упорядоченной структуры, вещества больше похожи на жидкости по внутреннему строению. Их свойства:
1) свойства не зависят от направления (изотропия свойств);
2) нет определённой температуры плавления;
3) текучи.
Отличие кристаллических и аморфных тел по внутреннему строению