Открытие электрона
На протяжении всей второй половины XIX века физики активно изучали феномен катодных лучей. Простейший аппарат, в котором они наблюдались, представлял собой герметичную стеклянную трубку, заполненную разреженным газом, в которую с двух сторон было впаяно по электроду: с одной стороны катод, подключавшийся к отрицательному полюсу электрической батареи; с другой —анод, подключавшийся к положительному полюсу. При подаче на катодно-анодную пару высокого напряжения разреженный газ в трубке начинал светиться, причем при низких напряжениях свечение наблюдалось лишь в области катода, а при повышении напряжения — внутри всей трубки; однако при откачивании газа из трубки, начиная с какого-то момента, свечение исчезало уже в области катода, сохраняясь около анода. Это свечение ученые и приписали катодным лучам.
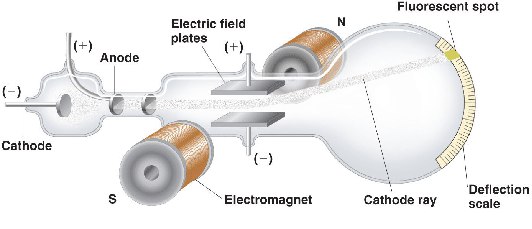
В 1897 году молодой английский физик Дж. Дж. Томсон выяснил, что соотношение между электрическим и магнитным полями, при котором их действие уравновешивается, зависит от скорости, с которой движутся частицы. Проведя ряд измерений, Томсон смог определить скорость движения катодных лучей. Оказалось, что они движутся значительно медленнее скорости света, из чего следовало, что катодные лучи могут быть только частицами, поскольку любое электромагнитное излучение, включая сам свет, распространяется со скоростью света. Эти неизвестные частицы. Томсон назвал «корпускулами», но вскоре они стали называться «электронами».
Модель атома Томсона
По Томсону атом представляет собой электронейтральную систему шарообразной формы радиусом, примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него. Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.

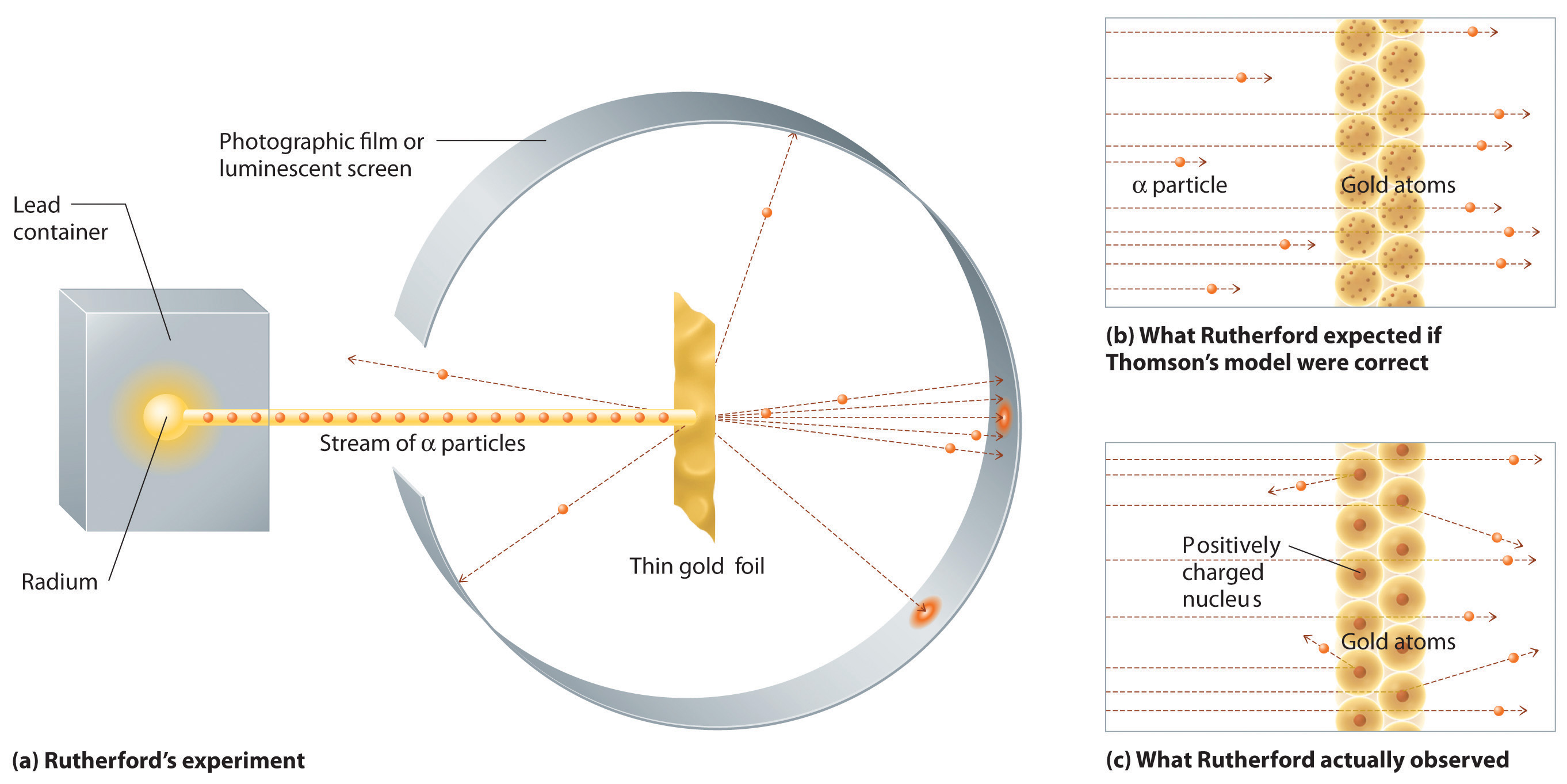
Опыт Резерфорда
Используя естественный источник радиоактивного излучения, Резерфорд построил пушку, дававшую направленный и сфокусированный поток частиц. Пушка представляла собой свинцовый ящик с узкой прорезью, внутрь которого был помещен радиоактивный материал. Благодаря этому частицы (в данном случае альфа-частицы, состоящие из двух протонов и двух нейтронов), испускаемые радиоактивным веществом во всех направлениях, кроме одного, поглощались свинцовым экраном, и лишь через прорезь вылетал направленный пучок альфа-частиц. Далее на пути пучка стояло еще несколько свинцовых экранов с узкими прорезями, отсекавших частицы, отклоняющиеся от строго заданного направления. В результате к мишени подлетал идеально сфокусированный пучок альфа-частиц, а сама мишень представляла собой тончайший лист золотой фольги. В нее-то и ударял альфа-луч. После столкновения с атомами фольги альфа-частицы продолжали свой путь и попадали на люминесцентный экран, установленный позади мишени, на котором при попадании на него альфа-частиц регистрировались вспышки. По ним экспериментатор мог судить, в каком количестве и насколько альфа-частицы отклоняются от направления прямолинейного движения в результате столкновений с атомами фольги.
Ядерная модель атома
В 1911 г. Эрнест Резерфорд предложил ядерную модель атома.
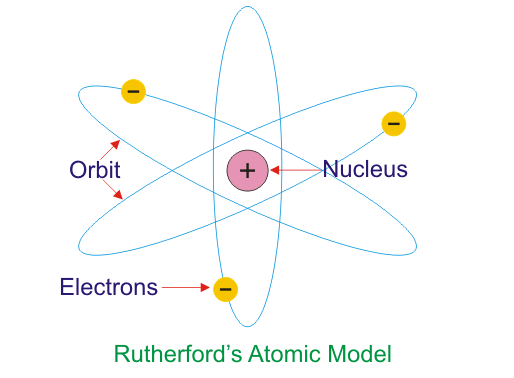
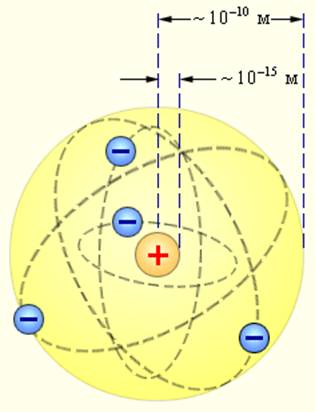
Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома (99,96%). Диаметр ядра не превышает 10-14 - 10-15 м. Атом в целом нейтрален. Вокруг ядра по замкнутым орбитам вращаются под действием кулоновских сил притяжения со стороны ядра электроны. Находиться в состоянии покоя электроны не могут.Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. То есть q = +Ze = -Ze, где Z - порядковый номер элемента в таблице Менделеева, e - элементарный заряд.
Планетарная модель атома, предложенная Резерфордом, несомненно явилась крупным шагом вперед в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц, однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.