Ядерная модель атома не могла объяснить следующие противоречия:
- при движении электрона по орбите он должен излучать электромагнитные волны, вследствие этого терять энергию и через 10-13 с прекратить свое существование.
- спектр излучения атома должен быть непрерывным, а не линейчатым.
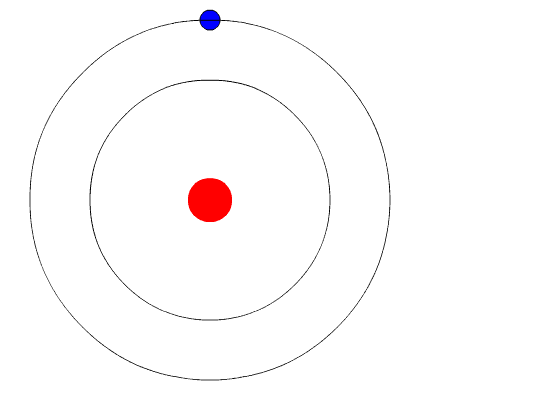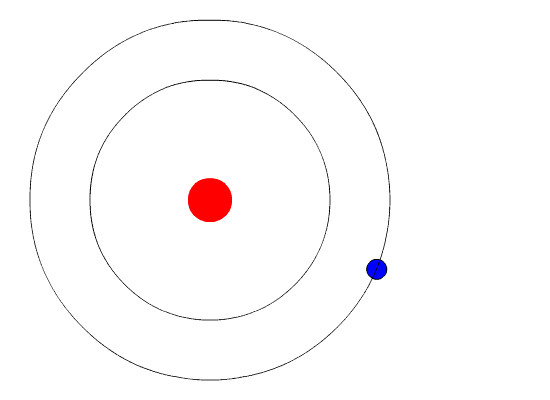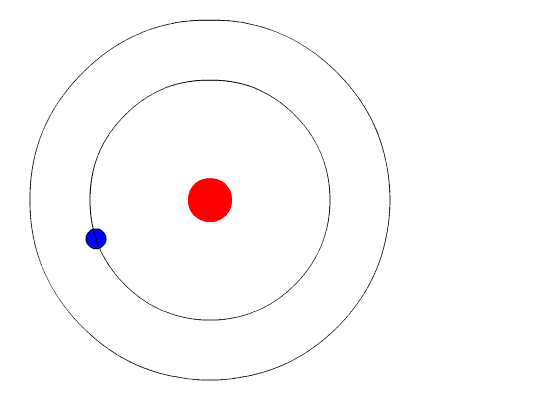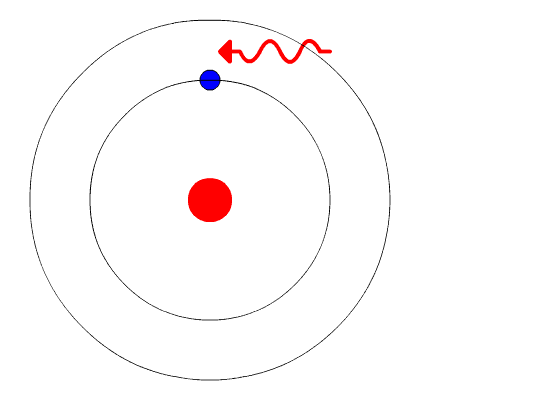
За отправную точку Бор принял новые постулаты квантовой механики, согласно которым на субатомном уровне энергия испускается исключительно порциями, которые получили название «кванты». Немецкий физик Макс Планк воспользовался положением о том, что атомы излучают свет отдельными частицами (позже Альберт Эйнштейн назвал их «фотоны»), для разрешения застарелой проблемы излучения черного тела. Используя концепцию фотонов, Альберт Эйнштейн теоретически объяснил фотоэлектрический эффект. За свои работы и Планк, и Эйнштейн получили по Нобелевской премии.
Бор развил квантовую теорию еще на шаг и применил ее к состоянию электронов на атомных орбитах. Говоря научным языком, он предположил, что угловой момент электрона квантуется. Далее он показал, что в этом случае электрон не может находиться на произвольном удалении от атомного ядра, а может быть лишь на ряде фиксированных орбит, получивших название «разрешенные орбиты». Электроны, находящиеся на таких орбитах, не могут излучать электромагнитные волны произвольной интенсивности и частоты, иначе им, скорее всего, пришлось бы перейти на более низкую, неразрешенную орбиту. Поэтому они и удерживаются на своей более высокой орбите, подобно самолету в аэропорту отправления, когда аэропорт назначения закрыт по причине нелетной погоды.
Однако электроны могут переходить на другую разрешенную орбиту. Как и большинство явлений в мире квантовой механики, этот процесс не так просто представить наглядно. Электрон просто исчезает с одной орбиты и материализуется на другой, не пересекая пространства между ними. Этот эффект назвали «квантовым прыжком», или «квантовым скачком». Если электрон перескакивает на более низкую орбиту, он теряет энергию и, соответственно, испускает квант света — фотон фиксированной энергии с фиксированной длиной волны. На глаз мы различаем фотоны разных энергий по цвету — раскаленная на огне медная проволока светится синим, а натриевая лампа уличного освещения — желтым. Для перехода на более высокую орбиту электрон должен, соответственно, поглотить фотон.
Нильс Хендрик Давид Бор (1885 - 1962) в 1913 г. предложил квантовую модель атома, в основе которой лежат следующие постулаты.
I постулат Бора (постулат стационарных состояний): электрон в атоме может находиться только в особых (квантовых) состояниях, каждому из которых соответствует определенная энергия. Когда электрон находится в стационарном состоянии, вращаясь по орбите, он не излучает.
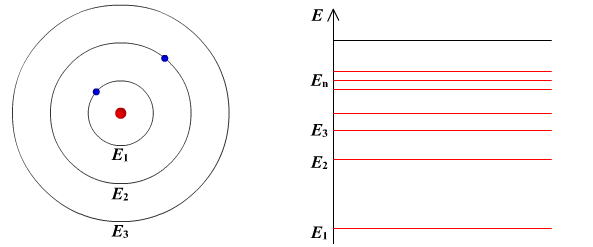
II постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергий электрона в данных состояниях.
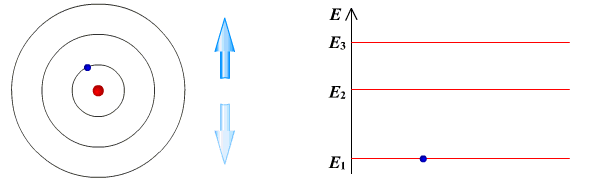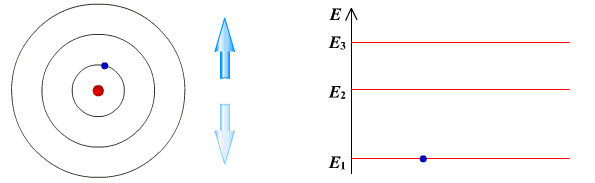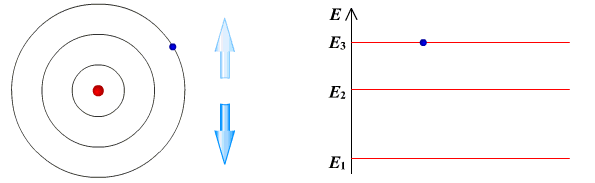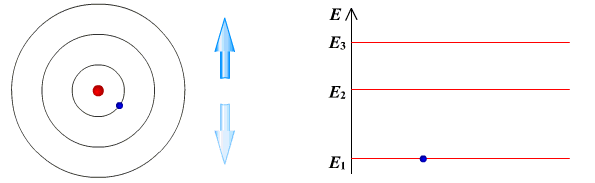
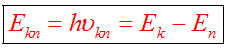
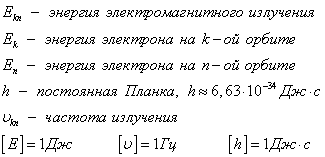
Если Еk>Еn, то происходит излучение энергии, если Еk<Еn - ее поглощение.
Состояние атома, которому соответствует наименьшая энергия, называется основным, а состояния с большей энергией - возбужденными. В основном состоянии электрон может находиться неограниченно долго, а в остальных состояниях не более 10-8 с.
II постулат Бора позволил объяснить линейчатую структуру атомных спектров.
III постулат Бора (правило квантования орбит): стационарные электронные орбиты находятся из условия
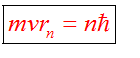

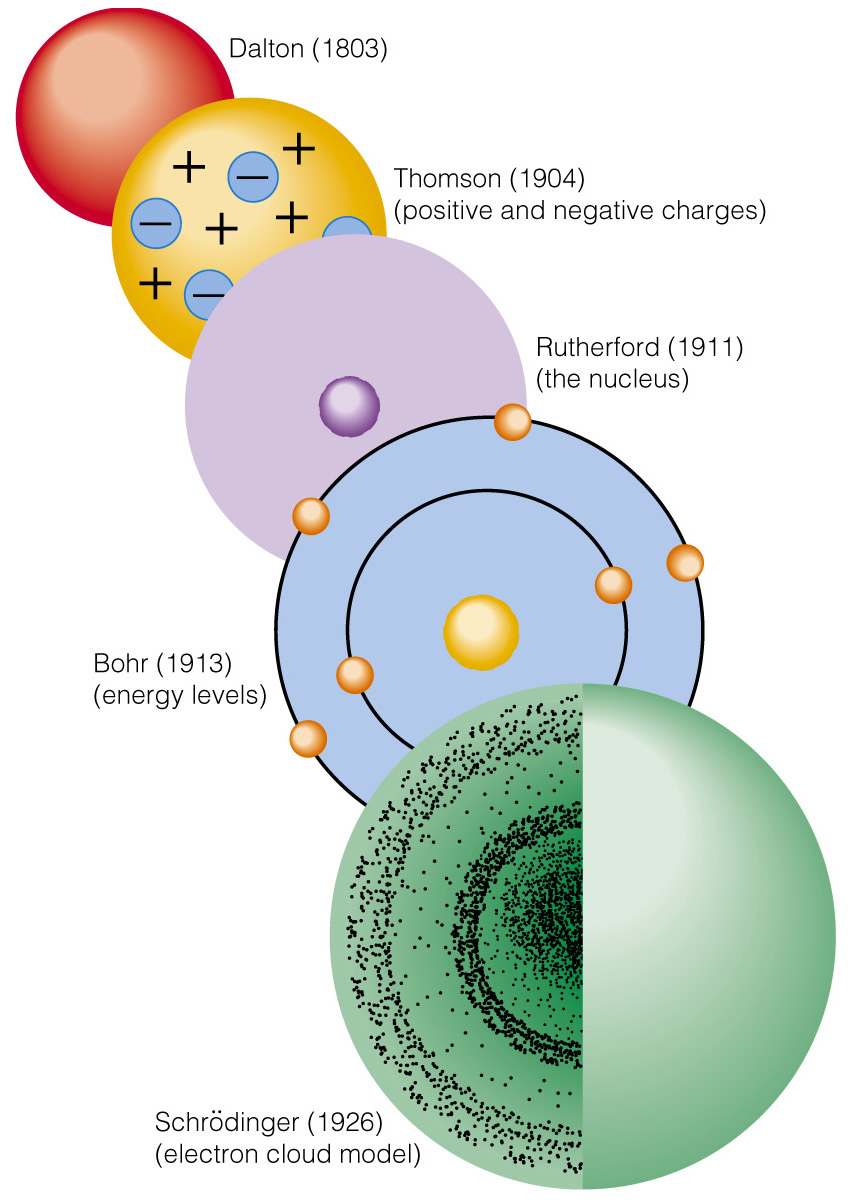
Эволюция атомных моделей