Атом водорода и водородоподобные системы – это системы, состоящие из ядра с зарядом Ze и одного электрона (например, ионы He+, Li2+).
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия Не+, двукратно ионизованного лития Li+ + и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Zе (для атома водорода Z =1):
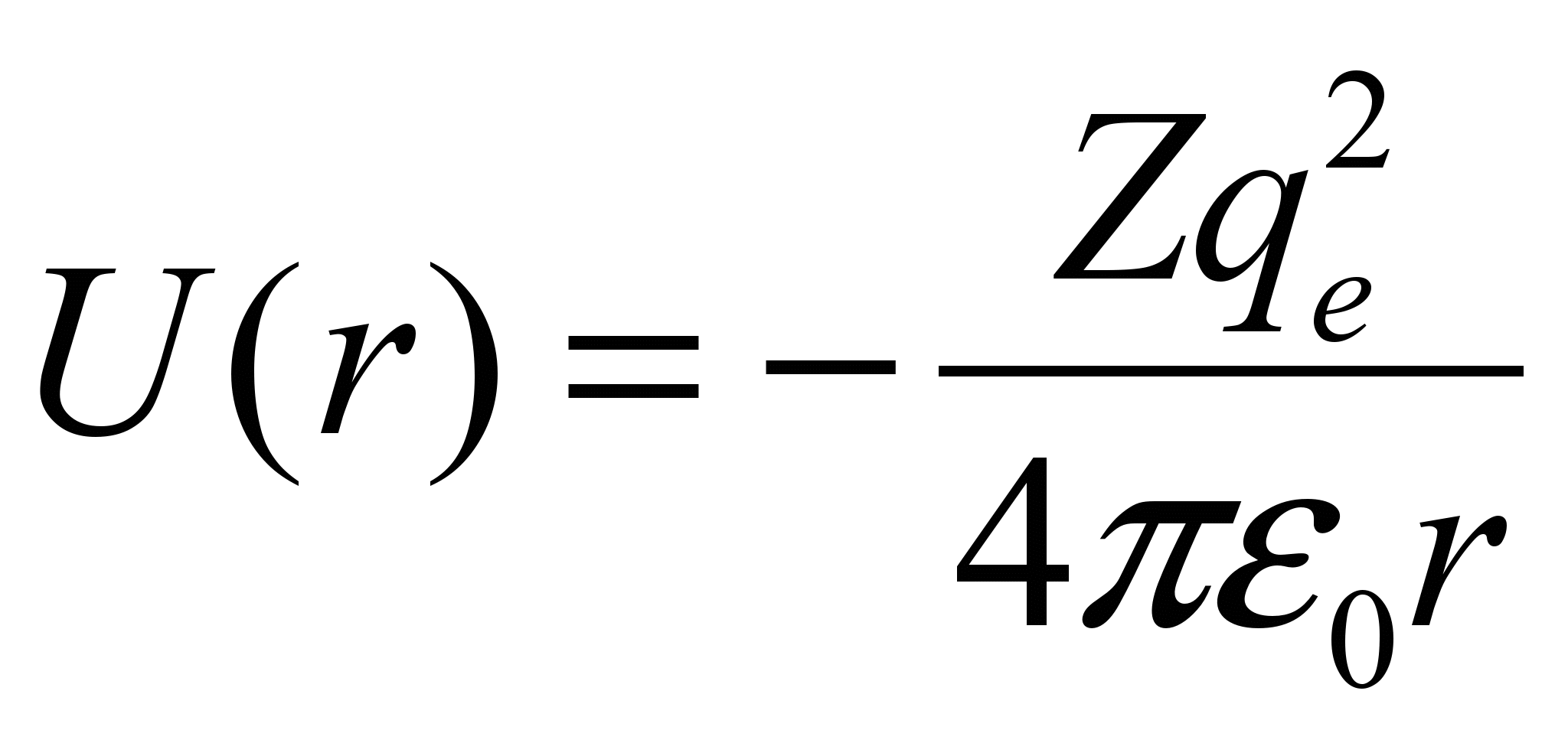
Состояние электрона в атоме водорода описывается волновой функцией Ψ, удовлетворяющей стационарному уравнению Шредингера
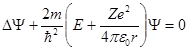
Его решения позволяют определить характеристики ВДПА:
Энергия. В теории дифференциальных уравнений доказывается, что такие уравнения имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции Ψ, только при собственных значениях энергии
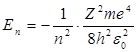 при n = 1, 2, 3...
при n = 1, 2, 3...
т. е. для дискретного набора отрицательных значений энергии.
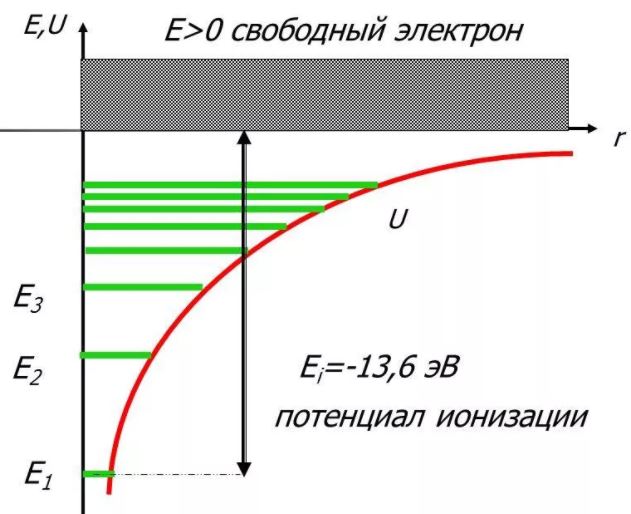
Таким образом, как и в случае «потенциальной ямы» с бесконечно высокими «стенками», решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Самый нижний уровень Е1, отвечающий минимальной возможной энергии, – основной, все остальные (Еn>E1, n = 2, 3,…) – возбужденные. При Е < 0 движение электрона является связанным, он находится внутри гиперболической «потенциальной ямы». Из рисунка следует, что по мере роста главного квантового числа п энергетические уровни располагаются теснее и при п=∞ Е∞= 0. При Е > 0 движение электрона является свободным; область непрерывного спектра Е >0 соответствует ионизованному атому.
Энергия ионизации атома водорода равна
Ei = - E1 = me4 / (8h2ε02) = 13,55 эВ.
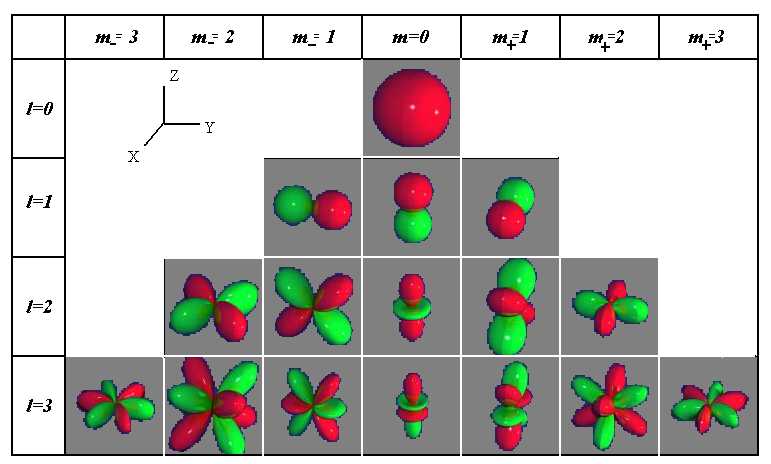
Квантовые числа. В квантовой механике доказывается, что уравнению Шредингера удовлетворяют собственные функции Ψ, определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным ml.
Главное квантовое число n, определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения, начиная с единицы:
n =1, 2, 3, ...
Из решения уравнения Шредингера вытекает, что момент импульса (механический и орбитальный момент) электрона квантуется, т. е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
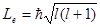
где l – орбитальное квантовое число,которое при заданном n принимает значения
l = 0, 1, ...,(n - 1)
т. е. всего п значений, и определяет момент импульса электрона в атоме.
Из решения уравнений Шредингера следует также, что вектор Le момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Lеz а направление z внешнего магнитного поля принимает квантованные значения, кратные ħ
Lez = ħml,
где тl – магнитное квантовое число,которое при заданном l может принимать значения
ml = 0, ±1, ±2, ..., ± l
т.е. всего 2l+1 значений. Таким образом, магнитное квантовое число тl определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2l + 1 ориентаций.
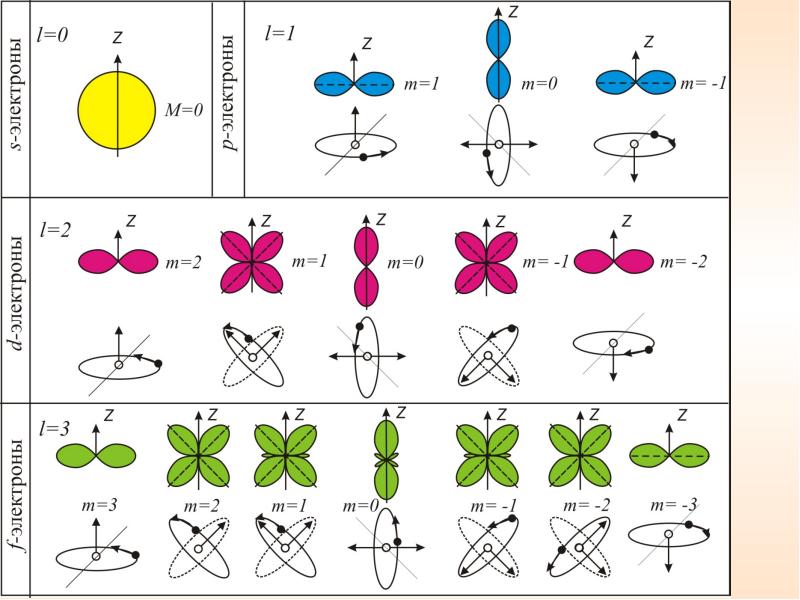
Так как при данном п орбитальное квантовое число l может изменяться от 0 до n – 1, а каждому значению l соответствует 2l + 1 различных значений тl, то число различных состояний, соответствующих данному n, равно
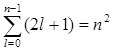
Опыт Штерна и Герлаха
О. Штерном и В. Герлахом были поставлены опыты (1921), целью которых являлось измерение магнитных моментов рm атомов различных химических элементов. Для определения орбитального момента импульса Ll и рm одного электрона опыты должны быть поставлены с атомами, у которых орбитальные механические (и магнитные) моменты всех электронов, кроме одного, взаимно компенсируют друг друга. Такими атомами являются атомы химических элементов, образующие первую группу периодической системы Менделеева и имеющие один валентный электрон на внешней оболочке.
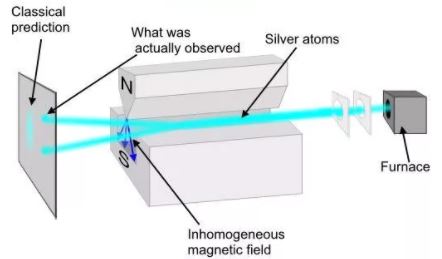
Идея опытов Штерна и Герлаха заключалась в измерении силы, действующей на атом в неоднородном магнитном поле. Опыты Штерна и Герлаха обнаружили ошибочность классического предположения отом, что магнитный момент рm и механический момент импульса Ll атома произвольно ориентируются относительно направления внешнего поля, и подтвердили наличие пространcтвенного квантования.
В трубке, где был создан вакуум порядка 10 -5 мм рт. ст., помещался источник пучка атомов — нагреваемый до высокой температуры серебряный шарик К. Атомы серебра вылетали с его поверхности со средней тепловой скоростью порядка 100 м/с, соответствующей температуре испарения серебра. Из этих атомов при помощи щелевых диафрагм В вырезался узкий пучок, проходящий через сильное и неоднородное магнитное поле, направленное перпендикулярно пучку. Основная трудность опыта состояла в том, чтобы достигнуть такой большой неоднородности магнитного поля, которая сказывалась бы на расстояниях порядка размеров атома. При такой величине неоднородности поля можно было рассчитывать получить значительную отклоняющую силу F, действующую на атом в магнитном поле. Необходимая неоднородность поля была достигнута в результате применения сильного электромагнита SN с полюсными наконечниками специальной формы. Приемником атомов серебра служила фотопластинка А.
Если бы момент импульса Ll атома (и его магнитный момент рm ) мог принимать произвольные ориентации в магнитном поле, то можно было бы ожидать непрерывного распределения попаданий атомов на пластинку с большей плотностью попаданий в середине пластинки и меньшей плотностью к ее краям. Опыты, проведенные с серебром и атомами других элементов периодической системы, привели к совершенно другому результату. На рисунке показана фотография результата опыта Штерна и Герлаха с литием. Из рисунка видно, что на фотопластинке получились две резкие полосы — все атомы отклонялись в магнитном поле двояко, что соответствовало лишь двум возможным ориентациям магнитного момента во внешнем поле. Момент импульса атома (и его магнитный момент) равен суммарным моментам электронов, поскольку магнитные моменты ядер имеют значительно меньшее значение, чем магнитные моменты электронов. Последние совпадают с суммарными моментами валентных электронов, так как моменты электронов замкнутых оболочек компенсируются.
Для объяснения этого американские физики Д. Уленбек (1900- 1974) и С. Гаудсмит (1902-1979) предположили, что электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве — спином.
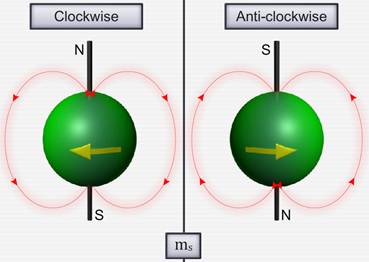
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) Ls, то ему соответствует собственный (спиновый) магнитный момент рms,. Согласно общим выводам квантовой механики, спин квантуется по закону
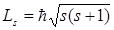
где s – спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz, спина квантуется так, что вектор Ls, может принимать 2s + 1 ориентаций. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2s + 1 = 2, откуда s = 1 / 2. Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением
Lsz = ħms,
где ms – магнитное спиновое квантовое число; оно может иметь только два значения: ms = ± ½.
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состоянии электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
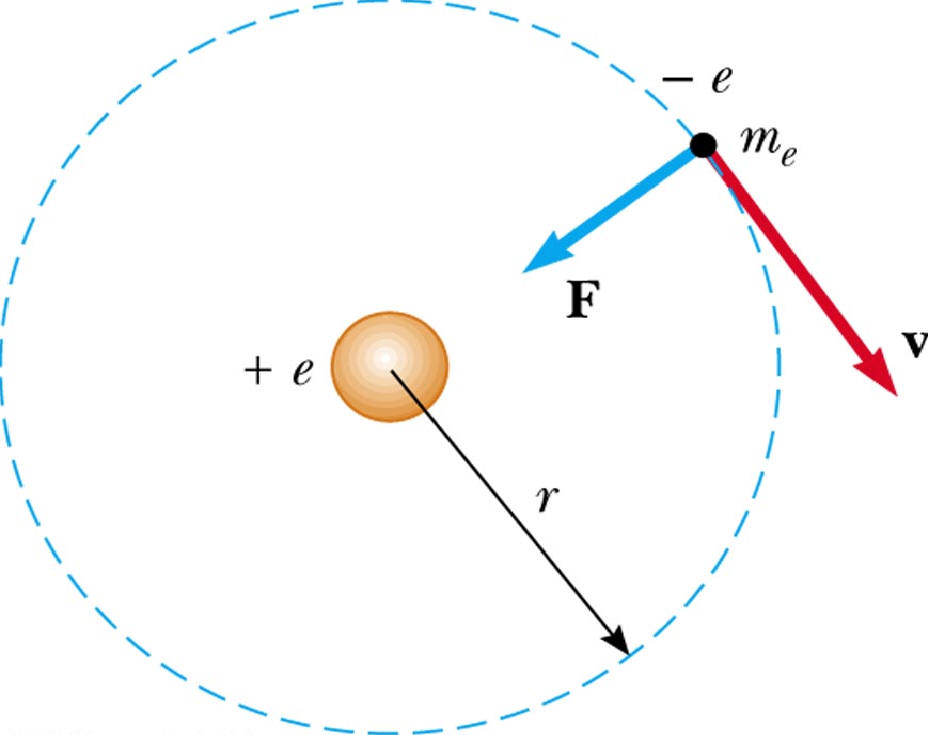
Движение электрона в атоме водорода по круговой орбите радиусом r описывается уравнением:
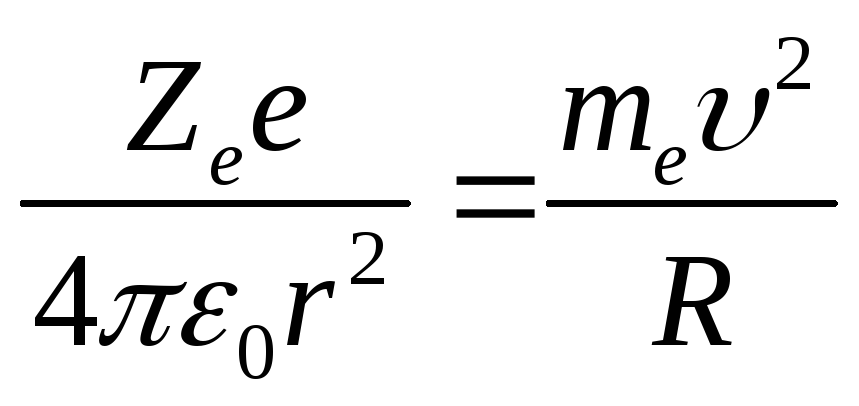
Найдем радиус n-орбиты:
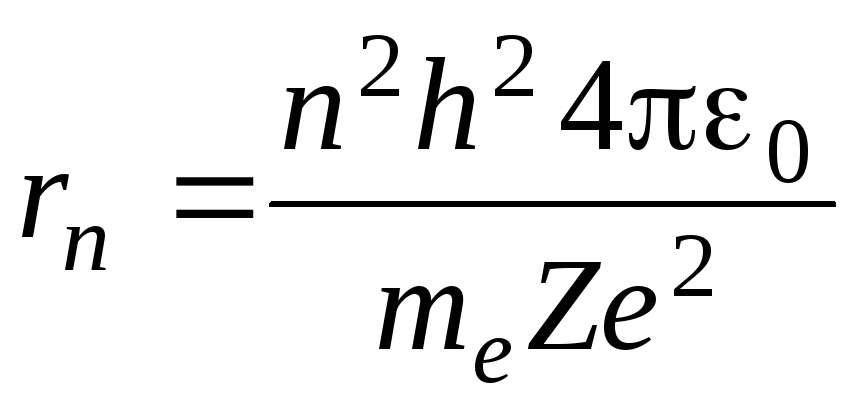
Для атома водорода радиус первой орбиты электрона (первый боровский радиус) равен
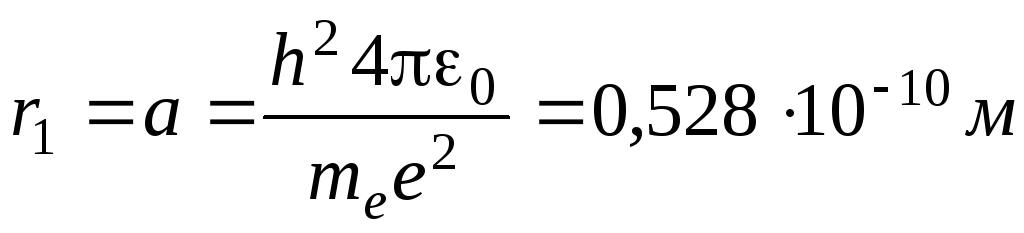
Принцип запрета Паули
Если перейти от рассмотрения движения одной микрочастицы (одного электрона) к многоэлектронным системам, то проявляются особые свойства, не имеющие аналога в классической физике. Пусть квантово-механическая система состоит из одинаковых частиц, например электронов. Все электроны имеют одинаковые физические свойства – массу, электрический заряд, спин и др. внутренние характеристики (например, квантовые числа). Такие частицы называют тождественными, которые невозможно экспериментально различить тождественные частицы.
В классической механике даже одинаковые частицы можно различить но положению в пространстве и импульсам. Если частицы в какой-то момент времени пронумеровать, то в следующие моменты времени можно проследить за траекторией любой из них. Классические частицы, таким образом, обладают индивидуальностью.
В квантовой механике положение иное. Из соотношения неопределенностей вытекает, что для микрочастиц вообще неприменимо понятие траектории; состояние микрочастицы описывается волновой функцией, позволяющей вычислять лишь вероятность (|Ψ|2) нахождения микрочастицы в окрестностях той или иной точки пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то разговор о том, какая частица находится в данной области, лишен смысла: можно лишь говорить о вероятности нахождения в данной области одной из тождественных частиц. Таким образом, в квантовой механике тождественные частицы полностью теряют свою индивидуальность и становятся неразличимыми.
Принцип неразличимости тождественных частиц ведет к определенному свойству симметрии волновой функции. Если при перемене частиц местами волновая функция не меняет знака, то она называется симметричной,если меняет антисимметричной.Изменение знака волновой функции не означает изменения состояния, так как физический смысл имеет лишь квадрат модуля волновой функции. В квантовой механике доказывается, что характер симметрии волновой функции не меняется со временем.
Установлено, что симметрия или антисимметрия волновых функций определяется спином частиц. В зависимости от характера симметрии все элементарные частицы и построенные из них системы (атомы, молекулы) делятся на два класса.
Частицы с полуцелым спином (например, электроны, протоны, нейтроны) описываются антисимметричными волновыми функциями и подчиняются статистике Ферми – Дирака; эти частицы называются фермионами.
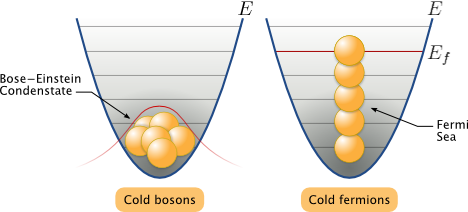
Частицы с нулевым или целочисленным спином (например, π-мезоны, фотоны) описываются симметричными волновыми функциями и подчиняются статистике Бозе – Эйнштейна; эти частицы называются бозонами.
Сложные частицы (например, атомные ядра), составленные из нечетного числа фермионов, являются фермионами (суммарный спин – полуцелый), а из четного бозонами (суммарный спин целый).
Зависимость характера симметрии волновых функций системы тождественных частиц от спина частиц теоретически обоснована швейцарским физиком В. Паули (1900—1958), что явилось еще одним доказательством того, что спин является фундаментальной характеристикой микрочастиц.
Квантово-механическая формулировка принципа Паули:
Два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной.
Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно принципу, данному п соответствует п2 различных состояний электронов, отличающихся значениями l и тl. Квантовое число ms, может принимать лишь два значения (±1/2). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
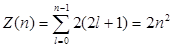
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой.
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до п – 1, число подоболочек равно порядковому номеру п оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в под оболочке с данным l равно 2 (2l+ 1).
Многоэлектронный атом
В многоэлектронном атоме, заряд которого равен Ze, электроны будут занимать различные «орбиты» (оболочки). При движении вокруг ядра Z‑электроны располагаются в соответствии с квантово‑механическим законом, который называется принципом Паули (1925 г.). Он формулируется так:
1. В любом атоме не может быть двух одинаковых электронов, определяемых набором четырех квантовых чисел: главного n, орбитального /, магнитногоm и магнитного спиновогоms.
2. В состояниях с определенным значением могут находиться в атоме не более 2n2электронов.
Значит, на первой оболочке («орбите») могут находиться только 2 электрона, на второй – 8, на третьей – 18 и т. д.
Таким образом, совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны располагаются по подоболочкам, которые соответствуют определенному значению /. Так как орбитальное квантовое число l принимает значения от 0 до (n – 1), число подоболочек равно порядковому номеру оболочки п. Количество электронов в подоболочке определяется магнитным квантовым числом ml и магнитным спиновым числом ms.